细胞外基质的力学特性在组织发育、再生和疾病等过程中影响细胞的命运。基质刚度作为最受关注的微环境生物物理因素之一,对临床研究广泛使用的间充质干细胞(MSCs)多向分化的影响已被广泛报道。然而,由于缺乏染色质三维结构图谱,基质刚度对干细胞的空间染色质结构重塑及其对干细胞的命运调控机制尚不清楚。
近日,北京航空航天大学生物与医学工程学院、医学科学与工程学院、生物力学与力生物学教育部重点实验室、北京生物医学工程高精尖创新中心樊瑜波教授/郑丽沙教授团队与张靖教授团队在生物材料领域权威期刊《Biomaterials》上发表了题为“Stiff extracellular matrix drives the differentiation of mesenchymal stem cells toward osteogenesis by the multiscale 3D genome reorganization”的研究论文(https://doi.org/10.1016/j.biomaterials.2024.122715)。樊瑜波教授、郑丽沙教授和张靖教授为该文共同通讯作者,北航生物与医学工程学院博士研究生纳静和邰呈正为该论文的第一作者,北京航空航天大学为唯一完成单位。
该研究通过高通量染色体构象捕获技术结合转录组测序技术,全面的解析基质刚度对染色质三维结构的影响及其对MSCs成骨分化的调控。该研究发现,硬基质可促进染色质压实,并增加染色体远程转录调控(图1)。
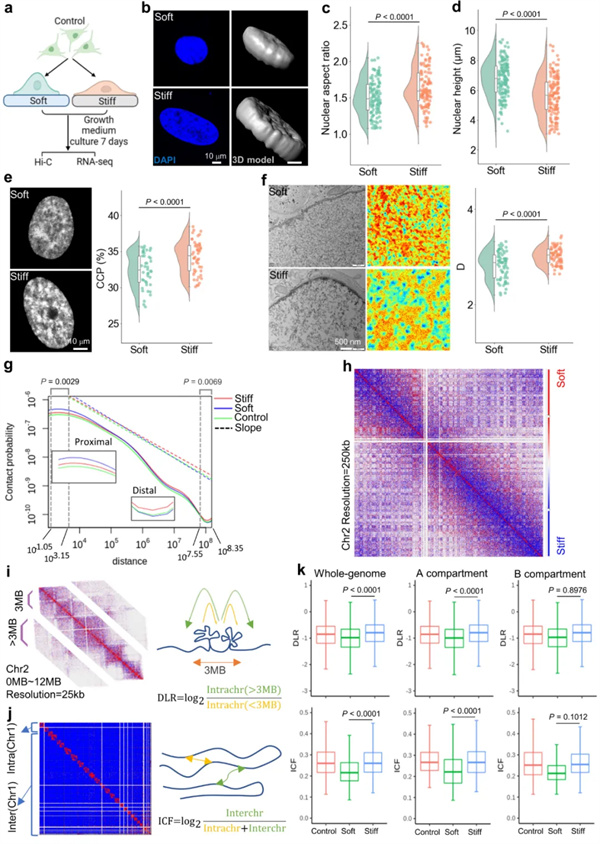
图1. 基质刚度诱导MSCs成骨分化过程中染色质结构的动态变化
与软基底相比,硬基质培养的MSCs中染色质凝集促进B-B区室相互作用,而A-A和A-B区室间相互作用较少,且A/B区室转换富集与骨架组织正向调节的基因(图2)。
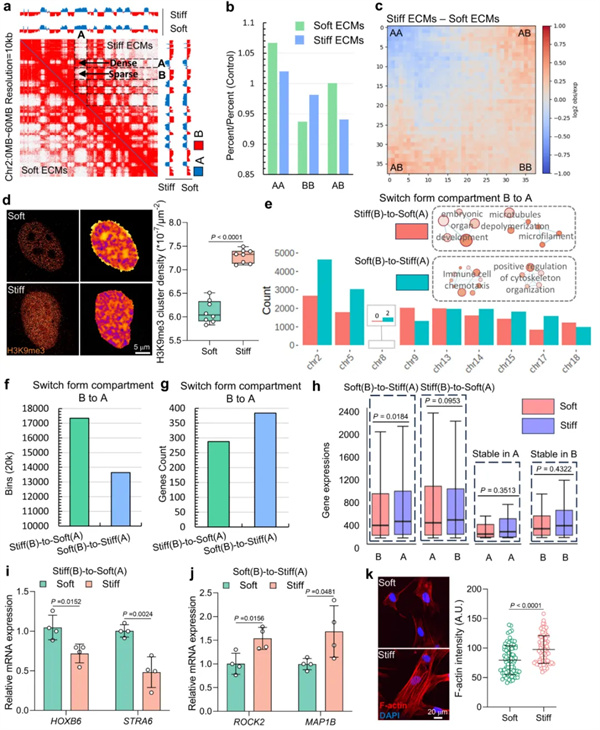
图2. 基质刚度对染色质区室相互作用和重组的影响
其次,基质刚度促使TAD重排,硬基底上具有更多合并的TAD,并富集成骨相关的转录因子SP1、ETS1和DCHS1等(图3,图4)。
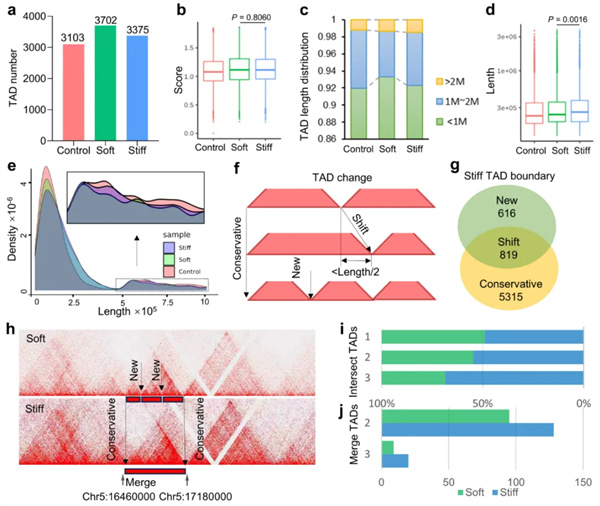
图3. 基质刚度促使TAD重排
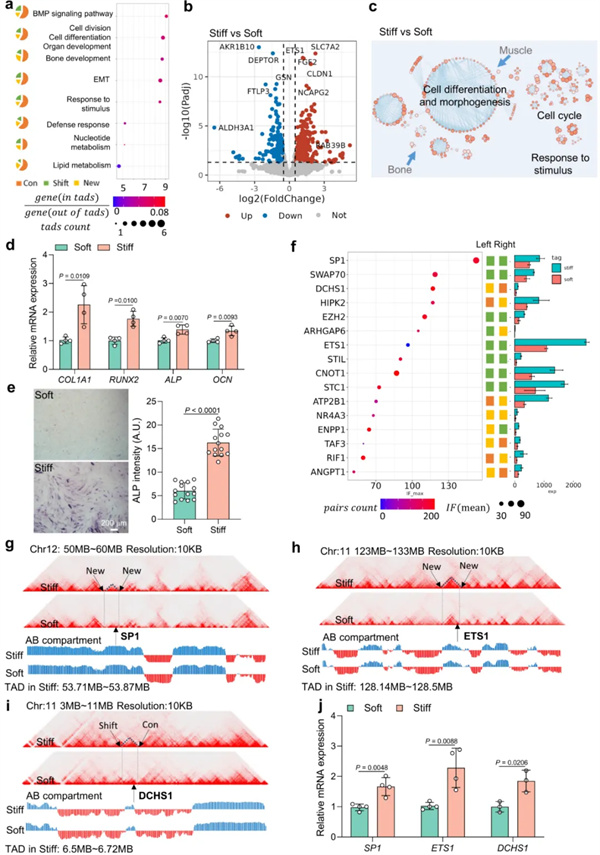
图4. 重排TAD与骨形成基因转录上调相关
此外,抑制SP1或ETS1的表达,硬基质诱导的MSCs成骨分化水平显著降低(图5)。
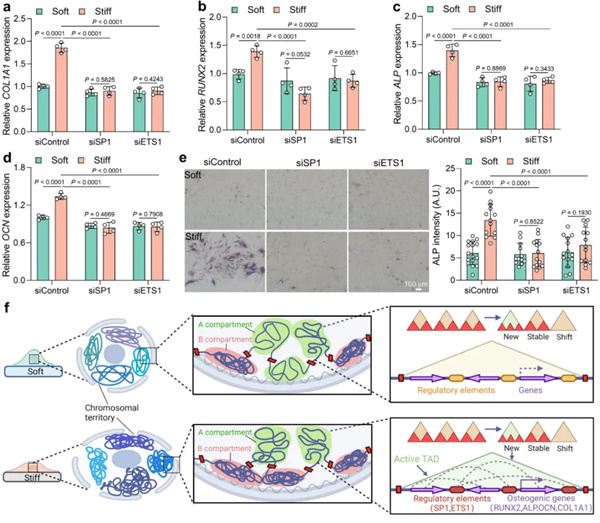
图5. 基质刚度诱导的MSCs成骨分化受SP1和ETS1调控
综上所述,该研究表明硬基质通过驱动染色质重塑,尤其是A/B区室转换和TAD的重排,上调成骨基因的表达以增强MSCs的成骨分化。该研究为基质刚度介导的MSCs成骨分化提供新的见解,揭示了力学因素对三维基因组结构重组和干细胞命运调控的新机制。
该研究工作得到了国家自然科学基金(332171310,11972067,12332019,U20A20390),北京市自然科学基金(L234072),北京市医院管理局临床医学发展专项(ZLRK202333),普通高校基本科研业务费,中国青年千人计划和北京航空航天大学青年人才计划等项目的资助。
排版 | 吴紫燕
审核 | 杨贤达